VER SIMULACION. CONSTRUCIÓN ÁTOMOS
EJERCICIO 1. El átomo de helio tiene dos neutrones y dos protones. Dado que el átomo es eléctricamente neutro, haz un dibujo de como están distribuidas las partículas fundamentales en el átomo de helio.
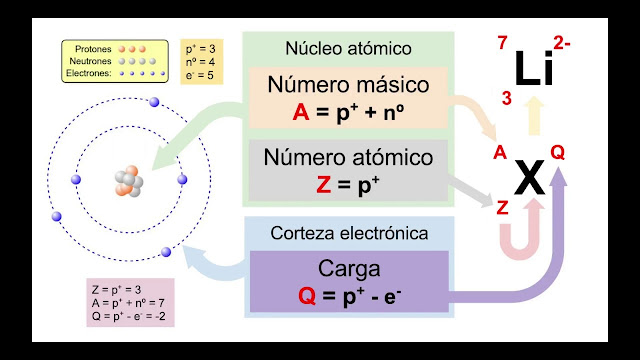
EJERCICIO 2. Indica el nº de protones, electrones y neutrones de los siguientes átomos: a) Oxígeno Z=8, A=16; b) Hierro Z=26, A=56
1. CONSTRUIR IONES.
Un átomo es neutro, tiene la misma carga positiva que negativa.
Un ion es un átomo o grupo de átomos cargados eléctricamente. Hay dos tipos:
CATIÓN: es un ion con carga positiva que se forma cuando un átomo o grupo de átomos pierde algún electron.
ANIÓN: es un ión con carga negativa que se forma cuando un átomo o grupo de átomos gana algún electrón.
 |
VER SIMULACIÓN: CONSTRUCCIÓN DE IONES
EJERCICIO 3. Mediante la simulación puedes observar distintos iones + y -. Copia en tu trabajo tres iones de cada tipo.
EJERCICIO 4. a) Un átomo neutro de litio tiene tres electrones y pierde uno ¿Qué ion se obtiene? ¿Es anión o catión? b) Un átomo neutro de flúor tiene nueve electrones y gana otro ¿Qué ion se obtiene? ¿Es anión o catión?
EJERCICIO 5.
HAY QUE MEMORIZAR LOS ELEMENTOS REPERSENTATIVOS: Grupo y elementos (no metales de color verde), elementos y símbolos.
-RADIO ATÓMICO: http://www.educaplus.org/sp2002/properiodicas/radatomico.html
-ENERGÍA DE IONIZACIÓN: http://www.educaplus.org/sp2002/properiodicas/energioniza1.HTML -AFINIDAD ELECTRÓNICA: http://www.educaplus.org/sp2002/properiodicas/afinidad.HTML
- ELECTRONEGATIVIDAD: http://www.educaplus.org/sp2002/properiodicas/electroneg.html
4. UNIONES ENTRE ÁTOMOS.
VER SIMULACIÓN II: FORMACIÓN DEL ENLACE IÓNICO
- Altos puntos de fusión y ebullición. Son sólidos a temperatura ambiente.
- Solubles en AGUA
- No conducen la electricidad en estado sólido, ya que sus cargas están fijas en la red cristalina, pero sí lo hacen en disolución o fundidos debido a que en estos casos los iones sí se pueden mover.
- Son duros, al ser fuerte la atracción entre iones, y frágiles, debido a las repulsiones que aparecen al desplazarse una capa sobre otra.
En este caso el enlace se forma al compartir un par de electrones
VER SIMULACIÓN: FORMACIÓN DEL ENLACE COVALENTE
| Propiedades enalces covalentes. Los compuestos covalentes moleculares : - Tienen puntos de fusión y ebullición bajos debido a que las fuerzas entre las moléculas son débiles, |
- No conducen la electricidad ya que no hay cargas ni electrones libres.
- Se disuelven en sustancias de las mismas carácteísticas.
| Tienen altos puntos de fusión y ebullición siendo sólidos a temperatura ambiente, a excepción del mercurio. - Presentan un brillo metálico. - No se disuelven con facilidad . |
- Conducen muy bien la electricidad y el calor, gracias a los electrones libres.
- Son dúctiles y maleables. A diferencia de los compuestos iónicos el desplazamiento de una capa sobre otra no provoca repulsiones, aunque será necesaria una cierta fuerza para desplazar las capas.
CUESTIONES Y PROBLEMAS.
1. ¿Cómo están ordenados los elementos en el Sistema Periódico?
2. Completa: El Sistema Periódico actual tiene ….periodos y …..grupos. Los elementos de un mismo...…………. se caracterizan por tener sus propiedades físicas similares. Los elementos de un mismo...………..tienen propiedades químicas parecidas
3. ¿Cómo varía el carácter metálico de los elementos al desplazarnos hacia la derecha en un periodo? ¿Y cómo varía en un grupo?
4. Clasifica los siguientes elementos de más a mmenos carácter metálico: B, K, Se, Fe, F
5.
El magnesio se une al bromo para formar el bromuro de magnesio.
¿Con qué tipo de enlace?
6.
Verdadero o falso. Justifica tus respuestas:
- A) Al formarse el enlace iónico, el átomo de metal pierde electrones y el de no metal los gana.
- B) Los iones de carga opuesta se atraen.
- C) Los compuestos iónicos disueltos en agua son malos conductores de la electricidad.
7. Cuales de los siguientes elementos son covalentes CO; LiCl; H2 , SO2 , F2, Fe
8.
Verdadero o falso. Justifica tus respuestas
- A) En los enlaces covalentes se comparten electrones
- B) Existen dos tipos de enlaces covalentes simples y dobles
- C) Los enlaces covalentes solo se forman entre no metales diferentes de la tabla periódica
- D) El agua es un compuesto iónico
- E)
El diamante es un solido covalente cristalino
10. Clasifica según su tipo de enlace las siguientes sustancias químicas: níquel (Ni), cloruro de magnesio (MgCl2); cinc (Zn) y monóxido de carbono (CO).
8. A) Explica por qué los sólidos metálicos son buenos
conductores de la electricidad.
B)
Los cristales iónicos no conducen la electricidad; ¿por qué?. Sin
embargo los compuestos iónicos fundidos o en disolución, conducen
la corriente eléctrica, ¿por qué?.
9.
.Cual es la diferencia entre un enlace covalente y otro iónico?.
- A) Un elemento metálico y un elemento no metálico se unen mediante enlace ..........................
- B) Un elemento metálico y otro elemento metálico se unen mediante enlace ............................
- C) Un elemento no metálico y otro elemento no metálico se unen mediante enlace ....................
- a) hidrógeno y oxigeno
- b) hierro y oxigeno
- c) sodio y oxigeno
- d) hidrógeno y calcio
11. De las sustancias O2, NH3, SiO2, diamante, Fe, NaCl. Indica:
- a) una sustancia conductora de la electricidad en estado solido
- b) una sustancia no conductora
- c) una sustancia conductora fundida (liquida)
- d) una sustancia soluble en agua
- e) una sustancia muy dura
- f) una sustancia blanda
- g) una sustancia frágil
- h) una sustancia dúctil y maleable.
- · Cristal iónico * Buen conductor de la electricidad y del calor
- · Cristal covalente * Resulta de la combinación de un metal y de un no metal
- · Cristal metálico * Es gas a cualquier temperatura
- · Molécula * Es un sólido formado por átomos de no metales
- · Átomo aislado * No conduce la electricidad y puede ser sólido, liquido o gas
1. Apuntes de formulación.
2. ACTIVIDADES.
Nombra:
1) Ba H2 2) CuO
3) SO3 4) Na2S
5) H2SO4 6) HI
7) FeCl3 8) CHU
9) Co(OH)2 10) BH3
11) CH4 12) HIO
13 Cu2O 14) Hg2O
15) PbO2 16) HI
Formula:
1. Hidróxido de hierro (III) 2. Óxido de azufre (IV)
3. Óxido de plomo (IV) 4. Cloruro de socio
5. Sulfuro de potasio 6. Ácido sulfúrico
7. Óxido de plata 8. Amoniaco
9. Hidruro de estaño (IV) 10. Hidróxido de aluminio.
11. Cloruro de calcio 12. Amoniaco
13 Hidruro de hierro(III) 14. Fosfano
15. Agua 16. Metano.







No hay comentarios:
Publicar un comentario