UNIDAD 2. ESTRUCTURA ATÓMICA DE LA MATERIA.
1. MODELOS ATÓMICOS.
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/modelos.htm
EJERCICIO 1. El enlace anterior te sirve de modelo para construir, en tu cuaderno, una tabla donde se especifique los experimentos que provocaron los distintos modelos y en qué consistían dichos modelos: modelo de Dalton, modelo de Thomson, modelo de Rutherford y modelo de Bohr
EJERCICIO 2. La carga eléctrica puede ser:
a) Positiva o negativa, las cargas positivas se atraen entre sí y las negativas se repelen.
b) Positiva o negativa, las cargas positivas se repelen entre sí y las negativas se atraen.
c) Positiva o negativa, las cargas de distinto signo se repelen y las de igual signo se atraen.
d) Positiva o negativa, las cargas de signo opuesto se atraen y las de igual signo se repelen.
2. MODELO DE RUTHERFORD.
VER VIDEO
EJERCICIO 3. Una vez visualizado el video, explica en qué consistió el experimento de Rutherford y las consecuencias más importantes que se dedujeron a partir de él.
EJERCICIO 4. Copia y completa en tu cuaderno:
- El átomo no es indivisible ya que al aplicar un fuerte voltaje a los átomos de un elemento en estado gaseoso, éstos emiten partículas con carga negativa:
- Al reaccionar 2 elementos químicos para formar un compuesto lo hacen siempre en la misma proporción de masas:
- Los átomos de los elementos en estado gaseoso producen, al ser excitados, espectros discontinuos característicos que deben reflejar su estructura electrónica:
- Al bombardear los átomos de una lámina delgada con partículas cargadas positivamente, algunas rebotan en un pequeño núcleo situado en el centro del átomo:
EJERCICIO 5. ¿Cuál fue la mayor contribución del experimento que realizó Ernest Rutherford?
3. CARACTERIZACIÓN DE LOS ÁTOMOS. NÚMERO MÁSICO.
a) Demostró que en el átomo la mayoría de la masa está concentrada en un pequeño núcleo de carga positiva y el resto consiste en un gran espacio vacío donde los electrones giran describiendo órbitas.
b) Confirmó el modelo de J. J. Thomson, el cual proponía que los electrones se encontraban «incrustados» en un núcleo positivo.
c) Demostró que en el átomo la mayoría de la masa está concentrada en un pequeño núcleo de carga negativa y el resto consiste en un gran espacio vacío donde los protones giran describiendo órbitas.
d) Logró identificar los neutrones.
Los modelos de Rutherford y Bohr pusieron de manifiesto la existencia de:
- Un núcleo cargado positivamente donde se encontraba la carga positiva y la mayor parte de la masa (los protones y neutrones)
- Electrones de carga negativa, girando alrededor del núcleo.
En un átomo neutro el número de protones y electrones tiene que ser el mismo.
Los protones (p+) tienen carga positiva y una gran masa.
Los electrones (e-) tienen carga negativa y una pequeña carga)
los neutrones (n) tienen una gran masa pero no tienen carga.
NÚMERO ATÓMICO, Z, es el número de protones de un átomo y es caracterítico de cada elemento.
NÚMERO MÁSICO, A, es la suma del número de prptones, Z, y de neutrones, N, que tiene un átomo.
EL SIGUIENTE EJEMPLO TE SERVIRÁ DE GUÍA:
EJERCICIO 6. Completa en tu cuaderno la siguiente tabla:
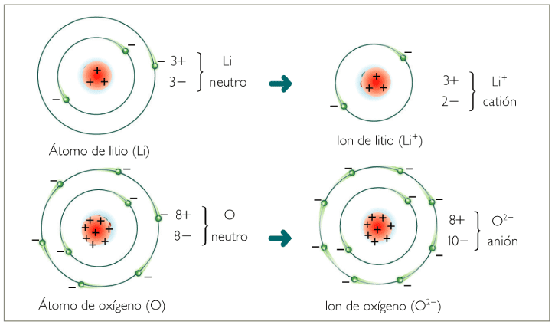
4. CONSTRUIR IONES.
Un átomo es neutro, tiene la misma carga positiva que negativa.
Un ion es un átomo o grupo de átomos cargados eléctricamente. Hay dos tipos:
CATIÓN: es un ion con carga positiva que se forma cuando un átomo o grupo de átomos pierde algún electron.
ANIÓN: es un ión con carga negativa que se forma cuando un átomo o grupo de átomos gana algún electrón.
 |
| VER SIMULACIÓN |
EJERCICIO 7. Mediante la simulación puedes observar distintos iones + y -. Copia en tu trabajo tres iones de cada tipo.
EJERCICIO 8. a) Un átomo neutro de litio tiene tres electrones y pierde uno ¿Qué ion se obtiene? ¿Es anión o catión? b) Un átomo neutro de flúor tiene nueve electrones y gana otro ¿Qué ion se obtiene? ¿Es anión o catión?
EJERCICIO 9.
5. RADIACTIVIDAD.
La radiactividad, radiaciones emitidas por unas seles de Uranio, fue descubierta de forma casual por H. Becquered.
Pierre y Marie Curie estudiaron las propiedades de estas radiaciones y descubrieron dos nuevos elementos: el radio y el polonio que también emitían estas radiaciones.
Tipos de radiación
Radiación alfa son partículas con carga positiva. Núcleos de helio.
Radiación beta son partículas con carga negativa, casi sin masa. Electrones
Radiación gamma son radiaciones electromagnéticas, al igual que la luz, de gran energía.
EJERCICIO 11. LÍNEA DEL TIEMPO: Marie Curie.
https://fisquiweb.es/Biografias/MCurie/LineaTiempoCurie.htm
a) La madre de Marie Curie murió de ...
b) El Premio Nobel de Física los compartió con ...
c) Su primera hija se llamó ...
d) Junto con su marido, descubrió dos nuevos elementos que son ...
d) Su primer trabajo fue de ...







No hay comentarios:
Publicar un comentario